 |
| Chapter 2 | download |
ATOM, MOLEKUL, DAN IONS
2.1 Teori Atom
Pada abad kelima SM. Filsuf Yunani, Democritus, mengungkapkan keyakinannya bahwa semua materi terdiri dari partikel-partikel yang sangat kecil dan tak terpisahkan, yang ia namakan atomos (artinya tak terpisahkan atau tak terpisahkan). Namun gagasan yang dikemukakan oleh Democritus tidak diterima oleh banyak orang pada zamannya.
Pada tahun 1808, seorang ilmuwan Inggris dan guru sekolah, John Dalton, merumuskan definisi yang tepat tentang blok penyusun materi yang tak terpisahkan yang kita sebut atom.
Karya Dalton menandai awal era modern kimia. Hipotesis tentang sifat materi yang menjadi dasar teori atom Dalton dapat diringkas sebagai berikut.
1. Unsur tersusun dari partikel yang sangat kecil yang disebut atom.
2. Semua atom dari suatu unsur adalah identik, memiliki ukuran, massa, dan sifat kimianya yang sama. Atom satu unsur berbeda dari atom semua unsur lainnya.
3. Senyawa tersusun dari atom lebih dari satu unsur. Dalam senyawa apa pun, rasio jumlah atom dari dua unsur yang ada adalah bilangan bulat atau pecahan sederhana.
4. Reaksi kimia hanya melibatkan pemisahan, kombinasi, atau penataan ulang atom; itu tidak mengakibatkan penciptaan atau kehancuran mereka.
Dari hipotesis Dalton dapat kita simpulkan bahwa konsep Dalton tentang atom jauh lebih rinci dan spesifik daripada Democritus. Hipotesis kedua menyatakan bahwa atom dari satu unsur berbeda dengan atom dari semua unsur lainnya. Dia hanya menyadari bahwa sifat berbeda oleh unsur-unsur seperti hidrogen dan oksigen dapat dijelaskan dengan asumsi bahwa atom hidrogen tidak sama dengan atom oksigen.
Dari hipotesis ketiga menunjukkan bahwa, untuk membentuk senyawa tertentu, kita tidak hanya membutuhkan atom dari jenis unsur yang tepat, tetapi juga jumlah atom tertentu. Hal ini menunjukkan hipotesis kedua Dalton mendukung hukum Proust tentang proporsi pasti menyatakan bahwa sampel yang berbeda dari sen
yawa yang sama selalu
mengandung
unsur-unsur penyusunnya dalam proporsi yang sama berdasarkan massa.
Selain itu, hipotesis ketiga ini juga mendukung hukum proporsi ganda.
Menurut hukum ini, jika dua unsur dapat bergabung membentuk lebih dari
satu senyawa, masa satu unsur yang bergabung dengan massa tetap unsur
lainnya berada dalam rasio bilangan bulat kecil.
Misalnya
karbon membentuk dua senyawa stabil dengan oksigen, yaitu karbon monoksida dan
karbon dioksida. Teknik pengukuran modern menunjukkan bahwa satu atom karbon
bergabung dengan satu atom oksigen dalam karbon monoksida dan dengan dua atom
oksigen dalam karbon dioksida. Jadi, perbandingan oksigen dalam karbon
monoksida dengan oksigen dalam karbon dioksida adalah 1: 2. Hasil ini konsisten
dengan hukum proporsi berganda.
Hipotesis keempat Dalton adalah cara lain untuk menyatakan hukum kekekalan massa, yaitu materi tidak dapat diciptakan atau dimusnahkan. Karena materi terbuat dari atom yang tidak berubah dalam reaksi kimia, maka massa juga harus dikonservasi.
2.2 Struktur Atom
 | |
| gambar 2.3 | download |
Berdasarkan teori atom Dalton, atom adalah unit dasar dari suatu unsur yang dapat masuk ke dalam kombinasi kimia yang sangat kecil dan tak terpisahkan. Namun, serangkaian penelitian berikutnya hingga abad ke-20 dengan jelas menunjukkan bahwa atom memiliki partikel yang lebih kecil (partikel subatomik). penelitian ini mengarah kepada penemuan -elektron, proton, dan neutron.
ELEKTRON
Dalam beberapa percobaan, dua pelat bermuatan listrik dan magnet ditambahkan ke bagian luar tabung sinar katoda (lihat Gambar 2.3). Ketika medan magnet hidup dan medan listrik mati, sinar katoda mengenai titik A. Ketika hanya medan listrik yang menyala, sinar tersebut mengenai titik C.Ketika medan magnet dan listrik mati atau ketika keduanya hidup Tetapi seimbang sehingga mereka membatalkan pengaruh satu sama lain, sinar tersebut mengenai titik B. Menurut teori elektromagnetik, benda bermuatan bergerak berperilaku seperti magnet dan dapat berinteraksi dengan medan listrik dan magnet yang dilaluinya. Karena sinar katoda ditarik oleh pelat yang membawa muatan positif dan ditolak oleh pelat yang membawa muatan negatif, ia harus terdiri dari partikel bermuatan negatif. Kita tahu partikel bermuatan negatif ini sebagai elektron. Gambar 2.4 menunjukkan pengaruh magnet batang pada sinar katoda.
 |
| gambar 2.4 | download |
Seorang
fisikawan Inggris, J.J. Thomson menggunakan tabung sinar katoda
menentukan rasio muatan listrik terhadap massa elektron individu. Angka
yang didapatnya adalah -1,76 X 10^3 C/g. Selanjutnya, tahun 1908 dan
1917, R.A. Milikan berhasil mengukur muatan elektron dengan sangat
presisi yaitu 21.6022 3 10219 C. Dari data itu ia dapat menghitung massa elektron.
massa elektron = muatan
muatan/massa
= -1.6022 X 10^-19 C
-1.76 X 10^8 C/g
= 9.10 X 10^-28 g
RADIOAKTIVITAS
Tahun 1895, Wilhelm Rontgen memerhatikan sinar katoda menyebabkan kaca dan logam memancarka sinar yang sangat tidak biasa. Karena sinar ini tidak bisa dibelokkan oleh magnet, membuktikan bahwa sinar ini tidak mengandung partikel bermuatan seperti sinar katoda. Rontgen menyebutnya dengan sinar x karena sifatnya yang tidak diketahui. Kemudian, Antoine Becquerel dan salah satu siswanya menemukan bahwa, seperti sinar X, sinar dari senyawa uranium sangat energik dan tidak bisa dibelokkan oleh magnet, tetapi berbeda dengan sinar X karena muncul secara spontan. Sejak itu, setiap elemen yang secara spontan memancarkan radiasi disebut radioaktif.
| gambar 2.5 | download |
Tiga jenis sinar yang dihasilkan oleh peluruhan atau pemecahan zat radioaktif seperti uranium (gambar 2.5).
a. Sinar alfa (α) terdiri dari partikel bermuatan positif, disebut partikel α, dan karena itu dibelokkan oleh pelat bermuatan positif.
b. Sinar beta (β), atau βpartikel, adalah elektron dan dibelokkan oleh pelat bermuatan negatif.
c. sinar gamma (γ), Jenis radiasi radioaktif ketiga terdiri dari sinar berenergi tinggi seperti sinar X, sinar tidak memiliki muatan dan tidak dipengaruhi oleh medan luar.
PROTON DAN INTI
| gambar 2.6 | download |
Pada awal 1900-an, dua fitur atom menjadi jelas: Mereka mengandung elektron, dan netral secara elektrik. Untuk menjaga netralitas listrik, sebuah atom harus mengandung muatan positif dan negatif dalam jumlah yang sama. Oleh karena itu, Thomson mengusulkan bahwa atom dapat dianggap sebagai bola materi positif yang seragam di mana elektron tertanam seperti kismis dalam kue (Gambar 2.6). Apa yang disebut model "puding plum" ini adalah teori yang diterima selama beberapa tahun.
Pada tahun 1910, Ernest Rutherford, melakukan penyelidikan menggunakan partikel alfa untuk menyelidiki struktur atom. Rutherford dan dua rekannya melakukan serangkaian percobaan menggunakan lembaran emas tipis dan logam lain sebagai target partikel alfa dari sumber radioaktif. Rutherford kemudian menjelaskan bahwa "sebagian besar atom pasti merupakan ruang kosong. Ini menjelaskan mengapa sebagian besar partikel α melewati lembaran emas dengan sedikit atau tanpa defleksi. Muatan positif atom, menurut Rutherford, semuanya terkonsentrasi di inti, yang merupakan inti pusat padat di dalam atom. Ketika sebuah partikel α mendekati inti dalam percobaan hamburan, ia mengalami gaya tolak yang besar dan karena itu terjadi defleksi yang besar. Selain itu, partikel aα yang bergerak langsung menuju inti akan ditolak sepenuhnya dan arahnya akan dibalik."
Neutron
Model struktur atom Rutherford meninggalkan satu masalah besar yang tidak terpecahkan. Diketahui bahwa hidrogen, atom paling sederhana, hanya mengandung satu proton dan atom helium mengandung dua proton. Oleh karena itu, perbandingan massa atom helium dengan atom hidrogen harus 2: 1. (Karena elektron jauh lebih ringan daripada proton, kontribusinya terhadap massa atom dapat diabaikan.) Namun kenyataannya, rasionya adalah 4: 1.
James Chadwick, pada tahun 1932. Ketika Chadwick membom selembar tipis berilium dengan partikel α, radiasi berenergi sangat tinggi yang mirip dengan sinar dipancarkan oleh logam. Percobaan selanjutnya menunjukkan bahwa sinar sebenarnya terdiri dari jenis ketiga partikel subatom, yang dinamai Chadwick neutron, karena terbukti sebagai partikel netral secara elektrik yang memiliki massa sedikit lebih besar daripada proton. Dalam inti helium ada dua proton dan dua neutron, tetapi dalam inti hidrogen hanya ada satu proton dan tidak ada neutron; Oleh karena itu, rasionya adalah 4: 1.
2.3 Nomor Atom, Nomor Massa, dan Isotop
Nomor atom (Z) adalah jumlah proton dalam inti setiap atom suatu unsur.
Nomor massa (A) adalah jumlah total neutron dan proton yang ada dalam inti atom suatu unsur. Kecuali untuk bentuk hidrogen yang paling umum, yang memiliki satu proton dan tidak ada neutron, semua inti atom mengandung proton dan neutron.
Secara umum, nomor massa diberikan oleh.
Nomor massa = nomor proton + nomor neutron
Nomor atom + nomor neutron
Atom dari suatu unsur tidak semuanya memiliki massa yang sama. Sebagian besar unsur memiliki dua atau lebih isotop, yaitu atom yang memiliki nomor atom yang sama tetapi nomor massa berbeda. Cara yang diterima untuk menunjukkan nomor atom dan nomor massa atom suatu unsur (X) adalah sebagai berikut:
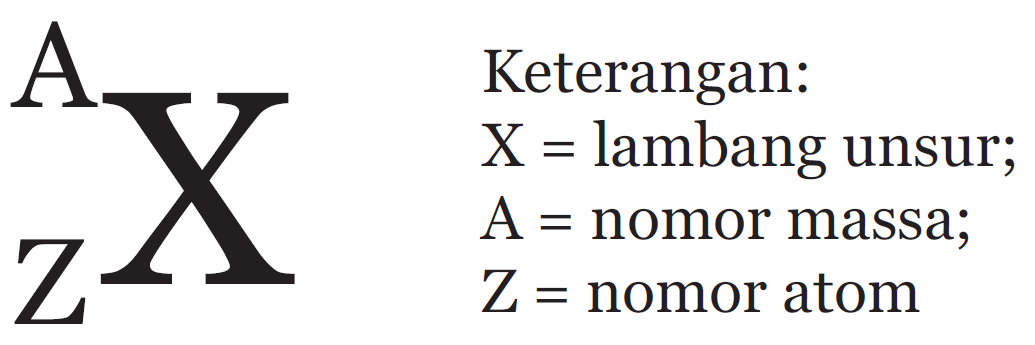 |
contoh:
1. tiga isotop hidrogen
 |
| download |
Satu, hanya dikenal sebagai hidrogen, memiliki satu proton dan tidak ada neutron. Isotop deuterium mengandung satu proton dan satu neutron, dan tritium memiliki satu proton dan dua neutron.
2. dua isotop umum uranium
U23592 U23892
isotop sebelumnya disebut uranium-235 (diucapkan "uranium dua tiga puluh lima") dan uranium-238 (diucapkan "uranium dua tiga puluh delapan").
2.4 Tabel Periodik

download

Tabel periodik adalah alat praktis yang menghubungkan sifat-sifat unsur secara sistematis dan membantu kita membuat prediksi tentang perilaku kimia. Tabel periodik, bagan di mana unsur-unsur yang memiliki sifat kimia dan fisik yang serupa dikelompokkan bersama. Unsur-unsur tersebut dapat dikelompokkan menjadi tiga kategori.
1. logam
2. non logam
3. metaloid
Dari kiri ke kanan sepanjang periode apa pun, sifat fisik dan kimia unsur-unsur tersebut berubah secara bertahap dari logam lic menjadi non logam.
Unsur-unsur sering disebut secara kolektif dengan nomor kelompok tabel periodik mereka (Kelompok 1A, Kelompok 2A, dan seterusnya). Namun, demi kenyamanan, beberapa grup elemen telah diberi nama khusus. Unsur Golongan 1A (Li, Na, K, Rb, Cs, dan Fr) disebut logam alkali, dan unsur Golongan 2A (Be, Mg, Ca, Sr, Ba, dan Ra) disebut logam alkali tanah. Golongan 7A (F, Cl, Br, I, dan At) dikenal sebagai halogen, dan unsur-unsur dalam Golongan 8A (He, Ne, Ar, Kr, Xe, dan Rn) disebut gas mulia..


Tidak ada komentar:
Posting Komentar