KUIS 3
chapter 1
1) Diantara pernyataan berikut yang merupakan perubahan kimia adalah...
A. es mencair menjadi air
B. batu lapuk menjadi pasir
C. kertas dilipat di atas abu
D. air menguap
E. buah yang membusuk
jawaban : E
pembahasan :
sifat kimia adalah sifat perubahan zat yang zat tersebut tidak dapat kembali ke keadaan semula setelah mengalami perubahan.
2) Dimensi dari besaran Daya yang benar adalah...
A. [M][L][T]-2
B. [M][L]2[T]2
C. [M]2[L]3[T]
D. [M][L]2[T]-3
E. [M][L][T]
jawaban : D
chapter 3
1) Suatu oksida nitrogen mengandung oksigen sebanyak 36,37% massa, maka rumus molekul senyawa tersebut adalah ….
A. NO
B. N2O3
C. NO3
D. N2O
E. N3O3
Jawaban: D
Pembahasan:
Diketahui:
gr oksigen = 36,67% = 36,67 gr
gr nitrogen = 100% – 36,67% = 63,33 gr
n N : n O
gr/Ar : gr/Ar = 63,33/14 : 36,67/16 = 4,6 : 2,3 = 2 : 1
Jadi, rumus molekul senyawa tersebut adalah N2O
2)Diketahui reaksi :

Jika reaksi diatas disetarakan makan koefisien a, b, dan c berturut-turut adalah . . .
a. 4, 1, 1
b. 4, 1, 2
c. 4, 1, 3
d. 4, 1, 4
e. 4, 1, 5
Jawaban : D
Pembahasan :
4Zn + NO3‾ + 10H+ → 4Zn²+ + NH4+
Samakan H dengan menambahkan H2O
4Zn + NO3‾ + 10H+ → 4Zn²+ + NH4+ + 3H2O
Maka koefisiennya :
aZn + bNO3‾ → cZn²+ + NH4+
4Zn + NO3‾ + 10H+ → 4Zn²+ + NH4+ + 3H2O
chapter 4
1) Nilai bilangan oksidasi dari Cl2 didalam Ca(ClO2)2 adalah . . .
a. 16
b. 6
c. 1
d. 4
e. 12
Jawaban : B
Pembahasan :
2) Diantara reaksi dibawah ini yang bukan merupakan reaksi redoks adalah . . .
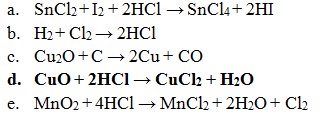
jawaban : D
Pembahasan :
Reaksi Redoks yaitu dimana reaksi yang mengakibatkan ada unsur yang mengalami kenaikan biloks disebut teroksidasi dan yang terjdi penurunan disebut tereduksi.
Maka jika dilihat dari soal diatas :
- Reaksi redoks (Option A)
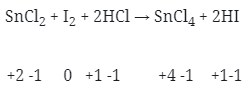
- Merupakan Reaksi redoks (Option B)
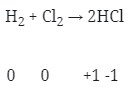
- Reaksi redoks (Option C)
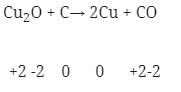
- Tidak terjadi reaksi redoks (Option D)
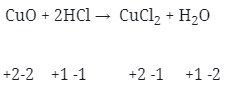
- Terjadi Reaksi redoks (Option E)
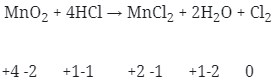
chapter 5
1) Sebuah silinder yang volumenya 1m3 berisi 1 mol gas helium pada suhu -1730 C. Apabila helium dianggap gas ideal, berapakah tekanan gas dalam silinder?…..
(R = 8,31 j/mol K)
A. 8,31 Pa
B. 83,1 Pa
C. 831 Pa
D. 8310 Pa
E. 83100 Pa
jawaban : C
pembahasan :
Diketahui :
V = 1m3
n = 1 mol
T = -1730 C
T = -173 0 C + 273K = 100K
R = 8,31 j/mol K
Ditanya :
Tentukan tekanan gas di dalam silinder
Jawab :
Sesuai dengan persamaan gas ideal, pV = nRT
sehingga,
2) Pada P, V, dan T yang sama, sejumlah gas X memiliki massa 2 kali massa gas CH4 (Ar N = 14, C = 12, O = 16, dan H = 1). Dari fakta tersebut dapat disimpulkan bahwa gas X adalah ....
(A) O2
(B) C2H2
(C) C2H6
(D) CO
(E) N2
jawaban : A
Bila P, V, dan T sama artinya n (jumlah zat) juga sama. Ingat persamaan P.V = n.R.T
Asumsikan terdapat 1 mol gas CH4 yang bermassa = {12+ (1×4)} g = 16 g.
Massa setiap 1 mol gas X = 2 × massa CH4
Massa setiap 1 mol gas X = 2 × 16 g
Massa setiap 1 mol gas X = 32 g
Massa tiap mol gas yang tersedia:
O2 = (2×16) g = 32 g
C2H2 = (12×2) g +(1×2) g = 26 g
C2H6 = (12×2) g +(1×6) g = 30 g
CO = (12 +16) g = 28 g
N2 = (2×14) g = 28 g
chapter 6
1)
1. Suatu campuran pereaksi di dalam tabung reaksi meyebabkan tabung tersebut menjadi panas jika dipegang. Penyataan yang tepat mengenai hal tersebut adalah….
a. Entalpi pereaksi bertambah
b. Entalpi peraksi berkurang
c. Entalpi pereaksi dan hasil reaksi bertambah
d. Entalpi pereaksi lebih besar daripada entalpi hasil reaksi
e. Entalpi hasil reaksi lebih besar daripada entalpi pereaksi
Jawaban: D
Pembahasan:
Jika suatu reaksi kimia menghasilkan panas, maka reaksi tersebut merupakan reaksi eksoterm. Pada reaksi eksoterm, entalpi reaksi bernilai negative (entalpi pereaksi lebih besar daripada entalpi hasil reaksi)
2) Jika diketahui ΔHc°C = -393,5 kJ mol‾¹ , berapa kalor yang terjadi pada pembakaran 1 kg arang, jika dianggap bahwa arang mengandung 48% karbon dan Ar C = 12?
a. 740 kJ
b. 470 kJ
c. 740 kJ
d. 470 kJ
e. 740 kJ
Jawaban : A
Pembahasan:
ΔHc°C = -393,5 kJ mol -1
massa C = 48/100 x 1000 gram
= 480 gram
Pada pembakaran 1 mol karbon dibebaskan kalor 393,5 kJ maka pada pembakaran 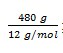 karbon dihasilkan kalor sebanyak:
karbon dihasilkan kalor sebanyak:
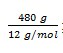 x 393,5 kJ/mol
x 393,5 kJ/mol
= 15.740 kJ
chapter 7
1) Bilangan kuantum magnetik (m) = -3 dimiliki oleh elktron dari atom yang memiliki kulit elektron minimal sebanyak. . . .
A. 2
B. 3
C. 4
D. 5
D. 6
Pembahasan :
Jika memiliki m = -3, artinya nilai bilangan kuantum azimuth elektron
dalam atom itu minimal adalah 3 karena nilai m itu bergantung pada harga
l ( jika l = 3, maka harga m -nya = -3, -2, -1, 0, +1, +2, +3).
Untuk l = 3, maka minimal sebuah atom harus memiliki harga bilangan
kuantum utama (n) adalah 4 karena nilai l itu dimulai dari 0, 1,
......sampai (n-1). Jadi jika n = 4, maka harga l = 0, 1, 2, 3.
Pada pembahasan soal no satu diatas sudah djelaskan bahwa bilangan
kuantum utama menyatakan kulit atom. n = 4 artinya elektron berada pada
tingkat energi ke empat atau kulit keempat (kulit N). Jadi agar suatu
elektron memiliki nilai bilangan kuantum magnetik (m ) = - 3, maka atom
itu harus memiliki setidaknya 4 buah kulit atom.
Jawaban : C
2) Diantara harga keempat bilangan kuantum di bawah ini yang mungkin untuk pengisian elektron pada orbital 3p adalah . . . . .
A. n = 3, l = 2, m = -1, s = +1/2
B. n = 3, l = 1, m = -1, s = +1/2
C. n = 3, l = 2, m = +1, s = +1/2
D. n = 3, l = 2, m = 0, s = +1/2
E. n = 3, l = 2, m = +2, s = +1/2
Pembahasan :
Dari orbital 3p kita dapatkan :
Harga n = 3
Harga l = 1 (karena sub kulitnya adalah p)
Jika l = 1, maka harga m yang mungkin adalah -1, 0, +1
Harga s yang mungkin hanya dua yaitu +1/2 dan -1/2
Jadi kemungkina nilai keempat bilangan kuantum suatu elektron yang menempati subkulit/ orbital 3p adalah :
n = 3, l = 1, m = -1, 0, +1 dan s = +1/2 atau -1/2
Jawaban : B
chapter 8
1) Dari pernyataan berikut, manakah pernyataan yang tepat?
a. Semakin besar afinitas elektron, maka suatu atom cenderung lebih mudah melepaskan elektron
b. Semakin kecil afinitas elektron, maka suatu atom cenderung lebih susah menerima elektron
c. Dalam satu periode, afinitas elektron berkurang dari kiri ke kanan
d. Afinitas elektron paling besar terdapat dalam atom logam
Jawaban : b. Semakin kecil afinitas elektron, maka suatu atom cenderung lebih susah menerima elektron
2) Perhatikan konfigurasi elektron empat unsur berikut!

Grafik yang tepat untuk menggambarkan hubungan antara afinitas elektron dengan nomor atom keempat unsur tersebut adalah ….

Pembahasan
Jika diperhatikan konfigurasi keempat unsur tersebut maka dapat diperoleh data:

Artinya, keempat unsur tersebut terletak dalam satu periode, tepatnya periode 2.
Dalam satu periode dari kiri ke kanan, afinitas elektron cenderung meningkat, kecuali pada golongan IIA dan VA.

Dengan demikian, afinitas elektron untuk keempat unsur tersebut akan naik kecuali pada unsur Q.
Jadi, grafik yang menggambarkan hubungan antara afinitas elektron dengan nomor atom keempat unsur tersebut adalah opsi (D).
chapter 9
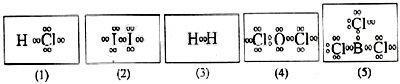
1) Perhatikan gambar struktur Lewis beberapa senyawa berikut!
Senyawa yang tidak mengikuti kaidah oktet atau duplet adalah ….
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
Jawaban: E
Pembahasan:
BCl3 tidak mengikuti kaidah oktet atau duplet karena pada atom B hanya terdapat 6 elektron.
2) Gambar struktur Lewis senyawa SO2 yang paling tepat adalah … (nomor atom S = 16; O = 8).
A. 
B. 
C. 
D. 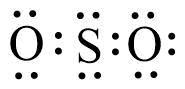
E. 
Jawaban: B
Pembahasan:
Untuk dapat mengetahui struktur lewis senyawa SO2, kita harus menentukan elektron valensi dari S dan O, yaitu:
16S = 2 8 68O = 2 6
seperti kita lihat, kedua unsur sama-sama memerlukan 2 elektron lagi untuk stabil. Sehingga, Struktur Lewisnya:

chapter 10
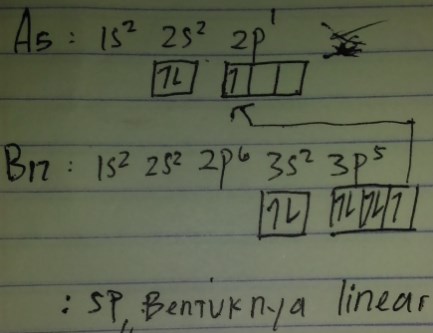
1) Jika nomor atom A=5 dan B=17,orbital hibrida yang terjadi pada molekul AB adalah….
A. sp
B. sp²
C. sp³
D. sp³d
E. sp³d²
Jawaban : A
Pembahasan :
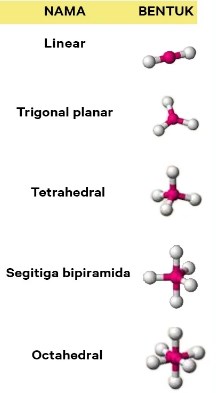
2) Molekul dengan orbital hibrida sp² memiliki bentuk orbital …
A. Linear
B. Segitiga datar
C. Segitiga piramida
D. Tetrahedral
E. Oktahedral
Jawaban : B
Pembahasan :
Segitiga datar atau trigonal planar merupakan bentuk molekul sp²
chapter 11
1)

- AsH3
- BCl3
- Cl2
- CO2
- XeF4
jawaban : A
Pembahasan :
Molekul-molekul akan memiliki gaya dipol-dipol bila molekul tersebut bersifat polar.
Setiap atom kebanyakan akan stabil bila elektron valensinya berjumlah 8
atau 2. Untuk senyawa kovalen bisa dicapai dengan menggunakan pasangan
elektron bersama atom-atom lain.
AsH3:
As atom pusat (jumlahnya hanya 1 atom).
As mempunyai e-valensi 5
H atom luar dengan e-valensi 1
H merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
H berjumlah 3 atom → X3
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 5 – (3 × 1) = 5 – 3 = 2
PEB = jumlah EB/2 = 2/2 = 1 → E1
Keterangan EB = elektron bebas, PEB = pasangan elektron bebas
AsH3→ sistem AX3E1 atau AX3E
AX3E → Bentuk molekul piramida segitga → polar
BCl3:
B atom pusat (jumlahnya hanya 1 atom).
B mempunyai e-valensi 3
Cl atom luar dengan e-valensi 7
Cl merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
Cl berjumlah 3 atom → X3
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 3 – (3 × 1) = 3 – 3 = 0
PEB = 0 → E0
BCl3→ sistem AX3E0 atau AX3
AX3→ Bentuk molekul segitiga datar → nonpolar
CO2:
C atom pusat (jumlahnya hanya 1 atom).
C mempunyai e-valensi 4
O atom luar dengan e-valensi 6
O merupakan atom divalen (perlu 2 elektron lagi untuk stabil)
O berjumlah 2 atom → X2
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 4 – (2 × 2) = 4 – 4 = 0
PEB = 0 → E0
CO2→ sistem AX4E0 atau AX4
AX4→ Bentuk molekul tetrahedral → nonpolar
Cl2:
Cl2 atau Cl – Cl → molekul diatomik → nonpolar.
XeF4:
Xe atom pusat (jumlahnya hanya 1 atom).
Xe mempunyai e-valensi 8
F atom luar dengan e-valensi 7
F merupakan atom monovalen (perlu 1 elektron lagi untuk stabil)
F berjumlah 4 atom → X4
Jumlah EB = valensi atom pusat – (jumlah atom luar × elektron yang diperlukan per atom)
Jumlah EB = 8 – (4 × 1) = 8 – 4 = 4
PEB = jumlah EB/2 = 4/2 = 2 → E2
XeF4→ sistem AX3E2
AX3E2 → Bentuk molekul segiempat datar → nonpolar
Kesimpulan, dari pilihan molekul yang tersedia hanya AsH3 yang bersifat polar. Jadi yang memiliki gaya tarik menarik adalah AsH3 saja. Molekul lain semua bersifat nonpolar, tidak punya gaya dipol-dipol.
2) Pada peristiwa tegangan permukaan duketahui gaya tegang 4N. Jika panjang permukaannya 20cm. besar tegangan adalah..
A. 2N
B. 8N
C. 200N
D. 20N
jawaban : D

chapter 12
1) Berikut ini adalah rumus struktur guanidin yang terdapat dalam urin dari hasil metabolisme protein:
Berdasarkan struktur senyawa guanidin, maka rumus molekul guanidin, jumlah atom N sebanyak 3 buah, sedangkan massa molar guanidin (Mr) :
Mr CN3H5 = (12x1) + (14×3) + (5×1)
= 59
sehingga :
% massa N dalam CN3H5 = (index N x Ar N / Mr guanidin) × 100%
= ((3×14) / 59) × 100%
= 71,19%
2) Didalam suatu larutan yang telah dibuat dari 5 gram kristal NaOH yang dilarutkan ke dalam air hingga volumenya 500 mL, konsentrasinya adalah …. (Mr NaOH = 40)
a. 0,1 mol/L
b. 0,5 mol/L
c. 0,25 mol/L
d. 0,7 mol/L
e. 0,35 mol/L
Jawaban : C
Pembahasan :
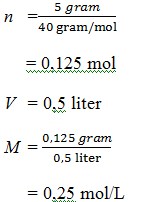


Tidak ada komentar:
Posting Komentar