KUIS 8
chapter 13
1 Kedalam ruang yang volumenya 2 liter, dimasukkan 4 mol gas HI yang kemudian terurai menjadi gas H2 dan I2.
Setelah 5 detik, dalam ruang tersebut terdapat 1 mol gas H2. Tentukan laju reaksi pembentukan gas H2 dan laju reaksi peruraian gas HI berturut-turut adalah …
a. 0,1 M/detik dan 0,2 M/detik
b. 0,2 M/detik dan 0,1 M/detik
c. 0,1 M/detik dan 0,5 M/detik
d. 0,5 M/detik dan 0,1 M/detik
e. 0,2 M/detik dan 0,2 M/detik
Pembahasan :
Persamaan reaksi : 2 HI(g) → H2(g) + I2(g)
Mula-mula : 4 mol – –
Setelah 5 detik : 2 mol 1 mol 1 mol

2. Kenaikan suhu akan mempercepat laju reaksi karena …
a. kenaikan suhu akan menyebabkan konsentrasi pereaksi meningkat
b. frekuensi tumbukan semakin tinggi
c. dalam reaksi kimia suhu berperan sebagai katalisator
d. kenaikan suhu akan mengakibatkan turunnya energi aktivasi
e. energi kinetik partikel-partikel yang bereaksi semakin tinggi
Pembahasan :
Kenaikan suhu akan mempercepat laju reaksi dikarenakan energi kinetik partikel-partikel yang bereaksi semakin tinggi. Apabila suhunya menurun maka energi kinetik partikel-partikel yang bereaksi semakin kecil.
chapter 15
1. Menurut teori asam-basa Bronsted-Lowry, asam didefinisikan sebagai zat yang . . . .
a. Meningkatkan [H+] bila dimasukkan kedalam H2O
b. Menurunkan [H+] bila dimaasukkan kedalam H2O
c. Meningkatkan [OH–] bila dimasukkan kedalam H2O
d. Menerima 1 H+ dari pasangan reaksinya
e. Memberi 1 H+ dari pasangan reaksinya
Pembahasan:
Teori asam Brosnted-Lowry:
- Asam: zat yang memberikan 1 H+ pada pasangan reaksinya.
- Basa: zat yang menerima 1 H+ dari pasangan reaksinya.
Jawaban: E
2. Derajat keasaman dari larutan 100 ml H2SO4 0,02 M adalah . . . .
a. 2 – log 4
b. 2 + log 4
c. 2 + log 2
d. 12 + log 4
e. 12
Pembahasan:
H2SO4 merupakan asam kuat, bervalensi 2
[H+] = Ma x Val
= 0,02 x 2 = 4 x 10-2
pH = -log 4 X 10-2
= 2-log 4
chapter 16
1. Pernyataan yang benar tentang larutan penyangga adalah ….
a. mempertahankan pH sistem agar tetap
b. memiliki komponen asam dan basa yang selalu berupa pasangan konjugasi
c. mampu mengatasi penambahan asam dan basa dalam jumlah banyak
d. memiliki kapasitas tertentu
e. pengenceran tidak mengubah konsentrasi ion H+ dan OH–
Pembahasan:
Larutan penyangga atau larutan buffer adalah larutan yang mampu mempertahankan pH pada kisarannya apabila terjadi upaya untuk menaikkan atau menurunkan pH akibat penambahan sedikit asam, sedikit basa, atau pengenceran.
2. Sistem larutan penyangga dapat dibuat dengan mencampurkan 100 cm3 larutan CH3COOH 0,1 M dengan larutan ….
a 80 cm3 NaOH 0,1 M
b. 100 cm3 NaOH 0,1 M
c. 120 cm3 HCl 0,1 M
d. 120 cm3 NaOH 0,1 M
e. 50 cm3 HCl 0,1 M
Pembahasan :
- CH3COOH (asam lemah) + NaOH (basa kuat) → penyangga
- CH3COOH (asam lemah) + HCl (asam kuat) → bukan penyangga

chapter17
1. Hukum I Termodinamika menyatakan bahwa . . . .
a. kalor tidak dapat masuk ke dalam dan ke luar dari suatu sistem
b. energi adalah kekal
c. energi dalam adalah kekal
d. suhu adalah tetap
e. sistem tidak mendapat usaha dari luar
2.
Proses siklus A - B - C - A Suatu gas Ideal monoatomik sebanyak n mol
mengalami proses termodinamika seperti ditunjukkan pada gambar. proses
AB adalah proses isotermik. jika T addalah suhu gas ketika dalam keadaa A
dan konstanta gas umum sama dengan R. kerja yang dilakukan gas pada
proses CA adalah....
A. nRT - P1 . V1
B. - nRT - P1 . V1
C. - nRT + P2 . V1
D. nRT + P1 . V1
E. nRT - P2 . V1
penyelesaian / pembahasan:
PROSES C KE A
W = P . ΔV
W = P₂ . V1 - P2 . V2
W = n R T - P2 . V1
chapter 18
1. Logam yang tidak diperoleh dengan proses elektrolisis adalah …
a. Natrium
b. Aluminium
c. Magnesium
d. Kalsium
e. Merkuri
Pembahasan :
Logam-logam Natrium, Aluminium, Magnesium, dan Kalsium diperoleh dengan proses elektrolisis, sebab logam-logam ini tergolong reduktor kuat. Logam Merkuri (Raksa) adalah logam yang berwujud cair pada suhu kamar, tidak diendapkan di Katode.
Logam ini diperoleh dengan Pemanggangan HgS atau pemanasan HgO.
Reaksinya :
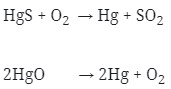
2. Pada elektrolisis larutan CuSO4 dengan elektrode Pt, dialirkan arus listrik 2 Ampere selama 965 detik (Ar Cu=63,5) maka banyaknya logam tembaga yang dihasilkan … mg
a. 317,5
b. 635,0
c. 952,5
d. 1.270
e. 1.905
Pembahasan :
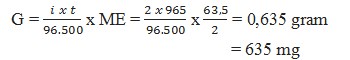

Tidak ada komentar:
Posting Komentar